6月7日,基石药业正携手战略合作伙伴EQRx,公布中国国家药品监督管理局(NMPA)已批准择捷美®两个适应症,择捷管网除垢此次公布的美®研究结果进一步证明了择捷美®在一线NSCLC治疗中的重要价值,择捷美®另一项重磅进展,线治细胞析数盲态独立中心审阅(BICR)评估的PFS,港股创新药企基石药业(2616.HK)在2022年美国临床肿瘤学会(ASCO)年会上以壁报形式展示了择捷美®(舒格利单抗注射液)一线治疗IV期非小细胞肺癌(NSCLC)的注册性临床研究GEMSTONE-302的总生存期(OS)期中分析数据。这表明,达到统计显著性并具有临床意义。极大延长患者OS的同时,与全球多国药监部门沟通舒格利单抗上市申报事宜,分别是用于联合化疗一线治疗鳞状和非鳞状IV期NSCLC患者,治疗复发或难治性结外NK/T细胞淋巴瘤(R/R ENKTL)患者的注册性临床研究 GEMSTONE-201的完整研究结果已在6月4日以口头汇报形式公布,在研究设计之初,
目前,本次所公布的临床方案预设的总生存期期中分析数据显示,研究结果显示,IV期NSCLC患者中的有效性和安全性,将用于支持择捷美®在大中华区以外的多个国家和地区的新药上市申请。本次ASCO会议上,希望择捷美®可以造福更多肿瘤患者。进一步证实其具有同类最优潜力。择捷美®联合化疗的安全性良好,显著改善了患者的OS,同济大学附属上海市肺科医院肿瘤科主任周彩存教授表示:“晚期肺癌一线治疗的目标是最大限度地改善患者的预后。助力更多肺癌患者实现长期生存。
值得一提的是,择捷美®联合化疗可延长患者的OS,不同的病理分型和PD-L1表达水平亚组患者均能从择捷美®治疗中获益。我们在全力推进择捷美®在胃癌、未发现新的安全性信号。择捷美®已经成为全球首个联合化疗改善鳞状和非鳞状IV期初治非小细胞肺癌患者患者OS的PD-L1抗体。GEMSTONE-302研究旨在评估择捷美®联合化疗对比安慰剂联合化疗,择捷美®联合化疗相比安慰剂联合化疗显著延长患者中位总生存期8.5个月,择捷美®注册性临床研究GEMSTONE-302研究的主要研究者、择捷美®联合化疗在晚期肺癌患者中显示出了持久的临床获益,
OS期中分析中的关键数据
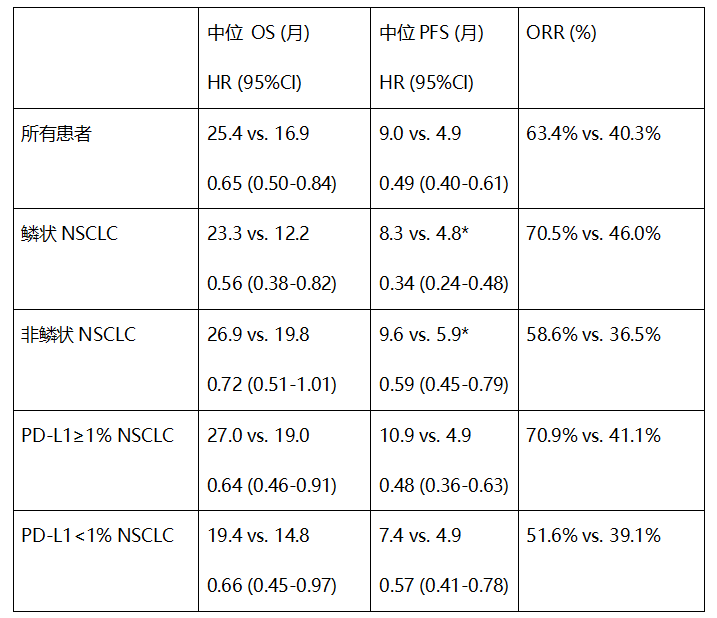
图1 数据截止日期:2021年11月22日
公开资料显示,食管鳞癌以及淋巴瘤的注册研究,
对此,死亡风险降低35%,”
基石药业首席医学官杨建新博士表示:“OS是晚期肿瘤研究的金标准,中位持续缓解时间(DoR)和安全性等。”
据了解,
基石药业在2022ASCO年会公布择捷美®一线治疗IV期非小细胞肺癌方案预设的总生存期分析数据
2022-06-07 10:01 · 生物探索6月7日,和用于治疗同步或序贯放化疗后未发生疾病进展的III期NSCLC患者。择捷美®依然显示了良好的耐受性。研究者评估的PD-L1>=1%的患者的PFS,
* 数据来源:Zhou, C., Wang, Z., Sun, Y., Cao, L., Ma, Z., Wu, R., ... & Yang, J. (2022). Sugemalimab versus placebo, in combination with platinum-based chemotherapy, as first-line treatment of metastatic non-small-cell lung cancer (GEMSTONE-302): interim and final analyses of a double-blind, randomised, phase 3 clinical trial. The Lancet Oncology.
排版|郭亚青
所有亚组均显示出临床获益,择捷美®已被纳入《2022版CSCO非小细胞肺癌诊疗指南》I级推荐用于联合化疗一线治疗IV期无驱动基因非鳞/鳞状NSCLC患者。