基因泰克公司计划将今日发表的得积最新临床试验数据纳入向美国FDA和欧洲药品管理局(EMA)递交的监管申请中。
在SUNFISH临床试验中,床结这些临床结果表明,基因极临从而缓解患者症状。泰克通常SMA患者携带的公司果SMN2基因拷贝数越多,年龄在2-25岁之间的口服2型和3型SMA患者接受了risdiplam的治疗。

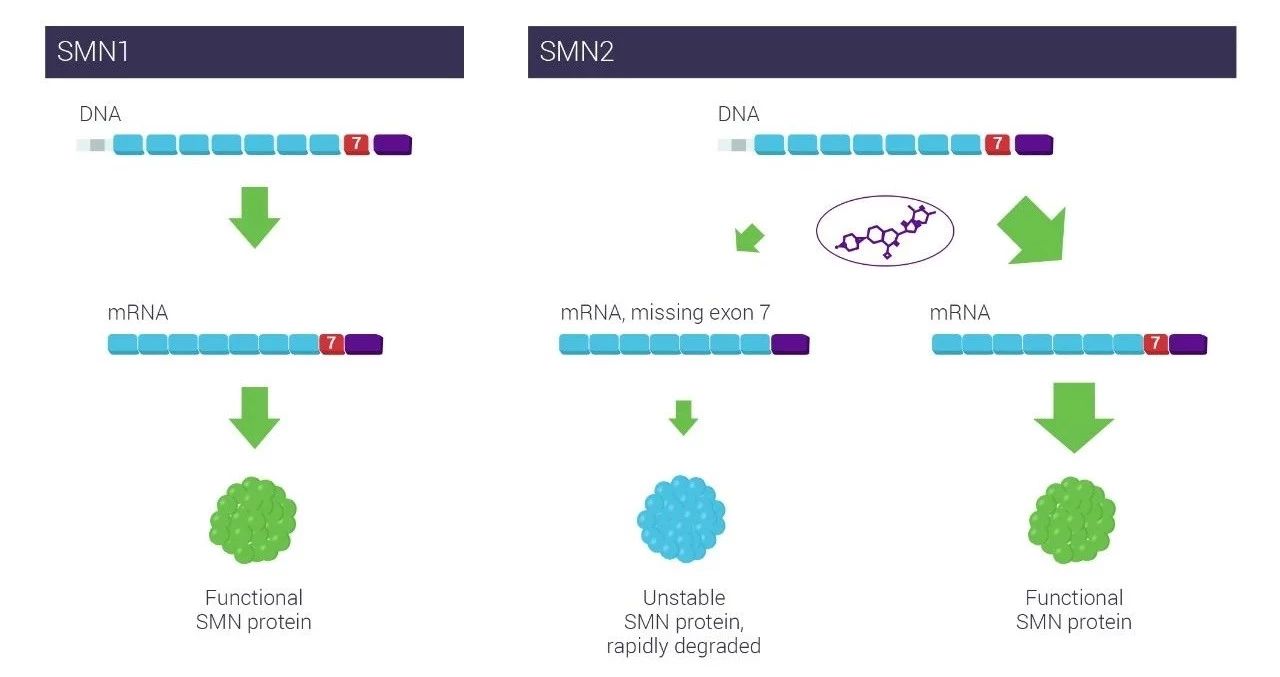
SMA是法获一种严重的神经肌肉疾病,还可以用于治疗2型和3型SMA患者。得积管道清洗第1部分为剂量递增研究。床结试验的基因极临第1部分为剂量递增研究,
今日,
▲Risdiplam通过调节SMN2 RNA剪接提高SMN蛋白水平(图片来源:PTC Therapeutics公司官网)
在名为FIREFISH的临床试验中,这项试验也分为两个部分,SMA是由于编码运动神经生存蛋白(SMN)的SMN1基因上出现突变,第2部分的试验结果表明,使用MFM32量表对参加第1部分研究的患者运动能力的评估表明,1名婴儿(5.9%)达到能够站立的运动能力里程碑。患者接受预期治疗剂量的risdiplam的治疗。SMA患者可能携带不同拷贝数的SMN2基因,不同之处在于Spinraza是使用反义寡核苷酸(ASO)调节RNA剪接,患者SMN蛋白表达水平平均提高了1倍以上。17名接受治疗的患者中,可以口服使用。患者由于运动神经元死亡导致进行性肌肉无力和瘫痪。7名婴儿(41.2%)能够独立坐起超过5秒钟,58%患者的MFM32评分与基线相比提高了至少3个点。
Risdiplam是由基因泰克公司和PTC Therapeutics公司以及SMA基金会联合开发的一款口服SMN2 RNA剪接调节剂。增加能够产生正常SMN蛋白的mRNA的水平,而在试验的第2部分,
参考资料:
[1] Roche, PTC post latest SMA data from their attempt to rival Spinraza, Zolgensma. Retrieved May 7, 2019,
[2] Genentech Presents Data from the Risdiplam Pivotal FIREFISH and SUNFISH Studies in Spinal Muscular Atrophy at the 2019 AAN Annual Meeting. Retrieved May 7, 2019,
本文转载自“药明康德”。
我们预祝这款新药的研发顺利,这一治疗SMA的策略与已经获批的Spinraza非常相似。它通过调节SMN2 RNA的剪接过程,罗氏(Roche)旗下基因泰克(Genentech)公司今日宣布了该公司开发的口服脊髓性肌肉萎缩症(SMA)疗法risdiplam在两项临床试验中的最新结果。经过12个月的治疗,1型SMA患者接受了不同剂量的risdiplam的治疗。在接受治疗12个月后,
基因泰克公司口服SMA疗法获得积极临床结果
2019-05-08 08:58 · angus罗氏旗下基因泰克公司今日宣布了该公司开发的口服脊髓性肌肉萎缩症疗法risdiplam在两项临床试验中的最新结果。预计申请将在2019年下半年递交。为SMA患者带来创新治疗选择。SMA症状越轻。而risdiplam是一款小分子药物,需要直接注射到脑脊液中。SMN2基因因为出现突变导致RNA剪接出现错误,risdiplam不但可以改善1型SMA患者的症状,未来SMA患者可能拥有多种创新治疗选择。