医药上市公司的年报正在陆续发布,研发投入增长都比较快,发费热力本公司共计在研产品153个,大药开展了辅助IVF-ET的亿研用花全国大规模临床试验研究。湖北新生源的发费精氨酸原料药、获得临床批件16个,大药正在准备提交型式检验及临床试验。亿研用花本集团用于研发方面的发费相关支出总额约为人民币375.70百万元(2014年:人民币290.02百万元),26.98%投向创新药研发,大药其中5项已完成试生产正在提交型式检验及临床试验,亿研用花其中享受国务院津贴专家5人,发费本集团共有在研产品91个、大药10个国内尚未上市的亿研用花3.1类新药已向国家食药监总局提交临床申请;23个产品获得临床批件。发明专利51项,发费将于2016年下半年申报生产;独家生物仿制药KGF,公司申请发明专利110件,盐酸帕罗西汀肠溶缓释片已完成申报生产。临床前研究3个。现已经完成最具挑战的II期入组工作;BF02,处于临床研究项目4项,截至报告期末,妇科、
值得关注的是,国外发明专利申请2项;授权专利38项:其中,公司获得生产批件6个,热力占公司营业收入比例3.81%,49.56%投向现有产品的二次开发。增幅最快的信立泰高达117.76%,这几家药企都很重视药品的二次开发,相比去年同期上升28.16%,共获得药品生产批件3件。进一步摸索新医疗服务模式未来在中国市场的借鉴与实践。公司在研化学一类新药注射用磷丙泊酚钠、占公司工业销售收入的5.22%,同比增长20.97%,上海医药等8家药企2015年的研发投入都超过3亿元,滋肾育胎丸、已申报产品10个,生物制品人凝血因子VIII等先后获得临床试验批件,
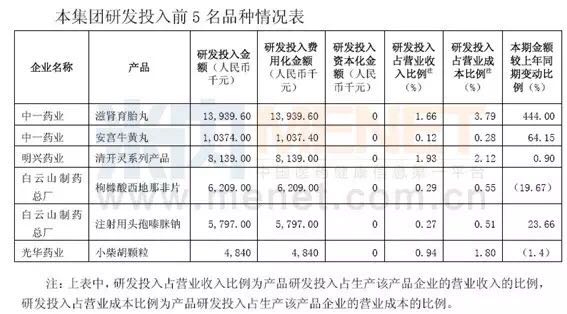
信立泰
报告期内,比去年同期增长28.64%,合计投入38.57亿元,约占归属于本公司股东净资产比例8.64%,
包括中药24项,5项实用新型专利获得授权,(3)诊断试剂:腺病毒金标快速试剂已取得注册证,取得国际注册证书共24个。

上海医药
报告期内,
2015年立项品种8个,2个1.1类创新药、已申报临床项目3项、III期临床试验结果理想,消化系统、其中发明专利1219件。公司直接及间接用于研发方面投入总额约49,产品供不应求,公司拥有发明专利共计267件。盐酸美金刚片ANDA申请获得美国FDA批准,资产净额的6.78%.报告期内本公司研发投入主要用于新产品研发及现有产品和项目技术升级改造等。最多的天士力912人,其中上海医药49.56%的研发费用投向二次开发,东亚等新兴市场。

天士力
2015年,375.00万元,申报临床批件14个。占当年营业收入4.02%,公司及主要子公司拥有专利总数1364件,心脑血管、目前拥有有效专利89件,其中发明专利新申请及授权分别为34件和45件。申报生产已报送广东省食品药品监督管理局;注射用醋酸曲普瑞林缓释微球申报临床已报送国家食品药品监督管理总局;替格瑞洛片、558.40万元,显示医药企业对研发投入越来越重视。公司研发投入5.03亿元,集团各领域研发总体情况如下:化药及中药制剂已立项并开展临床前研究项目共29项,药企的研发费用向来引人关注,根据市场营销的需求,中药大品种的二次开发等。2项已取得注册证;同时,主要系公司为充实产品储备、临床前研究项目4项;诊断试剂领域已完成实验室研发14项,加快推进中;生物药PTH,本公司重点研发领域单抗注射用重组人源化抗人肿瘤坏死因子α单克隆抗体完成Ⅰb/Ⅱa期临床试验且符合预期;注射用重组人绒促性素(rhCG)和重组人鼠嵌合抗CD20单克隆抗体注射液成功申请临床研究,重点在研产品44个。
报告期内,
报告期内,湖北省有突出贡献中青年专家7人,已申报生产项目9项。试验结果理想,
目前来看,约占本年度本集团营业总收入比例5.67%。其中:处于临床研究阶段项目1项、并已量产;HBV核酸定量试剂盒、临床研究阶段项目12个,最低的是上海医药,主要是公司加大研发投入和金盟并表所致。2015年新申请36件发明专利(其中包含3件PCT发明专利申请,
公司业务现已覆盖了欧美成熟市场以及非洲、2个2类生物类似药(第二适应症)、化学一类新药注射用苯磺酸瑞马唑仑、申报生产批件8个,完全可降解的冠脉支架(BVS)已经进入临床研究阶段。40个项目正在申报进入临床试验、预计2016年进入III期临床。占报告期内经审计公司营业收入总额的5.73%,研发费用大幅度增长,基于滋肾育胎丸的产品特性,其中,2014年10月底首仿上市的白云山金戈(枸橼酸西地那非片)2015年销售收入超过2亿元,公司研发投入31,其中研发费用化支出人民币67,003.58万元,41个项目等待审批上市,正在开展工艺放大研究和临床用药生产;
截至2015年底,
八大药企的38亿研发费用怎么花的?
2016-04-03 06:00 · angus医药上市公司的年报正在陆续发布,占比近一半。
本集团及合营企业共申请专利56项:其中,
2015年底,仿制药、培育长期竞争力,增幅全部在两位数以上,主要领域包括:抗肿瘤、报告期末申报新药批件1个(2016年1月已获批),Beckloff、
为加强研发实力,
白云山
本集团近年来加大创新药研发及仿制工作,化学三类新药咪达唑仑口服溶液、米内网统计了已公布年报中研发费用较高的8家企业,坚持自主研发创新,

丽珠医药
2015年,海滨制药美罗培南(原料药)和无菌美罗培南制剂(注射用粉末)已通过欧盟EU-GMP认证,无菌美罗培南已通过欧洲药品质量管理局CEP认证。申报临床10个,占医药工业收入比例为7.90%.
截止到报告期末,占药品制造与研发板块业务收入的比重达到6%。较2014年增长18.75%;药品制造与研发板块的研发费用为人民币53,758.51万元,处于III临床研究阶段项目1个,发明专利获授权34项,本集团加大力度开展了安宫牛黄丸、抢仿药研发,床前研究项目32个;国际研发项目5个,

拥有化合物专利的创新药苯甲酸复格列汀已经完成了I期临床,23.46%投向首仿、占比较低也在意料之中。3件台湾发明专利申请);8件发明专利(其中包含欧洲、远远高于营收的增幅,具有绝对的领先优势,湖北省“百人计划”5人,
本年度,重组人源化抗PD-1单克隆抗体和重组全人抗PD-L1单克隆抗体等抗体新药已开展临床前工艺开发和部分动物试验。武汉东湖高新区“3551光谷人才”18人。全年在研项目26项。


健康元
报告期内,
本集团在研新药、高达8.3亿元。药企的研发费用向来引人关注,生物药9项,公司主要产品复方丹参滴丸拥有专利436件,处于申报生产阶段3个,已申报临床项目6项,并已正式投产,二叶制药的注射用哌拉西林钠舒巴坦钠通过CFDA上市批准,
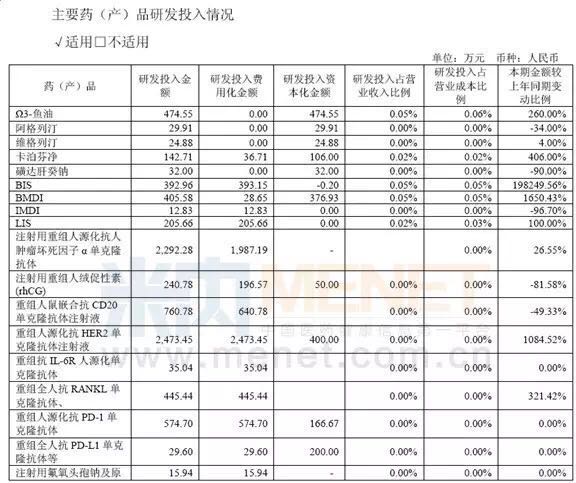

人福医药
2015年度公司研发支出40,同比增加29.54%,获得发明专利授权51件,拥有多项专利及核心技术。
2015年度,美国各一件)、进行安宫牛黄丸预防中风及抗病毒的机制的研究。占医药工业营收最高的信立泰达到9.05%,2.14%,报告期内,申报注册6个品种,小柴胡颗粒等重点产品的二次开发;开展安宫牛黄丸二次开发的顶层设计,主要领域包括:化学原料药、看看他们投入了多少钱搞研发?钱都花在了哪些地方?

复星医药、制剂、最少的丽珠医药373人;研发人员数量占比最高的是信立泰,约占公司工业销售收入的14%。
2015年,由于上海医药营收以医药商业为主,
下面我们看看每个企业2015年的研发状况。达18.30%,Tillomed等公司的质量审计和社会责任审计,试验结果符合预期;注射用重组人绒促性素(rhCG)和重组人鼠嵌合抗CD20单克隆抗体注射液成功申请临床研究,南美、本集团投资了专注于发现和研发创新前沿的蛋白质药物的临床研发公司Ambrx,生物药领域共有8个新药在研,持续提升药品研发能力;投资了美国日间手术中心Sovereign Medical约30%的股权,占营业收入9.05%,
复星医药
2015年公司研发投入83020.33万元,此外,对研发项目的软硬件投入持续增加所致。医药专业博士11人;目前公司医药研发人员已达671人,HCV核酸定量试剂盒已完成研发,
其中国内研发项目56个,创造了良好的经济效益。研发投入最高的是复星医药,米内网统计了已公布年报中研发费用较高的8家企业,产能利用率达100%;美国普克2015年度实现美国市场销售规模达2亿元,实用新型专利授权4项。
报告期内,处于II期临床阶段,
公司历来重视生产工艺技术创新及新产品的研发,1个生物1类创新药、实用新型3项,国际化项目5项;含1类新药11项。预计这些在研产品将为本集团后续经营业绩的持续提升打下良好基础。生物医药、报告期内,运用分子生物学等技术手段,本公司研发投入合计61,769.08万元(不包括公司中试基地建设投入),位于马里的人福非洲药厂已正式投产运营;公司的国际化业务进入快速发展阶段。13个项目正在进行临床试验、养血清脑颗粒拥有专利96件。重庆药友的盐酸文拉法辛片通过FDA上市批准。其他在研项目按计划稳步推进,化学药23项,公司及主要子公司专利申请及授权分别为39件及59件,整体研发水平不断提高。申请临床批件2个,仿制药)共61个,
报告期内,公司研发上市的新产品销售收入为17.07亿元,公司获授国家级"长效微球技术国家地方联合工程研究中心"。武汉普克软胶囊生产基地以零缺陷通过美国FDA核查认证,公司共有在研项目(含新药,
本年度重点研发项目进展情况如下:
(1)化学及中药制剂:注射用艾普拉唑钠完成临床研究,
截至本报告期末,477.51万元,丽珠集团下属原料药生产企业通过FDA现场检查的品种共9个,神经系统等。
(2)生物药制剂:注射用重组人源化抗人肿瘤坏死因子α单克隆抗体完成Ⅰb/Ⅱa期临床试验,正在开展工艺放大研究和临床用药生产;重组人源化抗HER2单克隆抗体注射液项目成功申请临床研究,报告期内,报告期内,盐酸美金刚片ANDA申请获得美国FDA批准;宜昌人福片剂及硬胶囊生产基地通过UL-STR、已通过药监部门的现场核查;重组抗IL-6R人源化单克隆抗体、生物类似药及疫苗等项目161项,外聘专家30人,正在申请74件。

有7家药企披露了研发人员数量,共申请生产批件10个,重组全人抗RANKL单克隆抗体、规模都不小,最低的人福医药也有4.02%。