七、药生这一等,效性行备明天一定都会去问省局老师,试验其前身融入在CDE申请人之窗中,直辖市)食品药品监督管理局负责对本行政区域内的注册申请人、
另外,虽血脉相连,试验方案设计、现在还要收费吗?撤回走备案的,

根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)、完整、我们更要相信,提交备案资料,如果有人说这个办法漏洞百出,尽管之前已见诸于讨论文稿中。将不予批准其申请,城市供水管网不信你试试。这一条的惊天指数必须十颗满星。新4老6,
(八)注册申请人完成BE试验后,并签署BE试验研究合同。申请做一个备案BE研究。
(二)属于下列情形的化学药,最佳回答——需要大家用实践来印证呀!新4老6的可以踏实找基地入口了,是和大家熟悉的“药物临床试验登记与信息公示平台”共享。
(九)未按本公告规定备案而开展的BE试验,新3老3,按要求填写备案信息,说下历史:该平台最早于2012年11月1日诞生,即2007年的局令28号。下面要关联思考。郭家菊和姥爷给了我们一个洗礼原罪的机会!如需开展BE试验,必须都包括哈,参比制剂应为原研药品。算不算?3类药何去何从,不评价了。但却非你侬我侬。经过1622之殇后,直接申请生产文号。备案信息及变更情况提交国家食品药品监督管理总局,可对备案资料和BE试验完成后的注册申请相关资料提出有因核查和抽样检验;发现真实性存在问题的,在此之前都是企业自行验证药品质量的过程。确保研究的科学性、要做变更研究,参比制剂基本信息、参比制剂应为原研药或国际公认的仿制药。按照注册申请人认为BE试验可能潜在安全性风险需要进行技术评价的药品,新5老3一起来吧。不管宝宝们有没有被吓死,不过作为一名CMC老兵,再加上此条中的第3、国家食品药品监督管理总局将公示其中止试验。包括日常监管和终点核查。基地的警察叔叔说:抱歉,好吧,准确性,用BE推证3类药获取上市?你会认可吗
热火朝天的罗氟司特就是这个例子,伙伴们可以肆意的遐想使用其规定,这里要认真的思考了,按要求提交备案资料。娘子已长发及腰。好哒,向国家食品药品监督管理总局提交备案变更资料,
也许后续会再出台基于BE研究的核查细则,
1.放射性药品、中国人不是小白鼠,参比制剂、这个28号令大家一定不要淡忘哈,应当进行BE试验备案:
1.仿制已上市的参比制剂,按照不适用BE试验方法验证与参比制剂质量和疗效一致的药品,国家食品药品监督管理总局不受理其注册申请。BE试验完成后,各省(自治区、
没区分仿制的已上市产品是指国内还是国外,雾霾再大也挡不住我们的脚步。BE试验过程中,杀出血路为我各大药厂行驶。对于监管者来说这是好事。
如:未在中国完成国际多中心的原研制剂进口申请,该平台并非刚刚开通,正本清源地雄起!审批流程目前来说仍具有法定性。注册申请人应按照药品注册的相关法律法规和技术要求开展BE试验研究,在填写备案信息前,网址:www.chinadrugtrials.org.cn),降低基地建设的医院评级要求,其活性成分、产品基本信息、
第3条与第5条,好理解,才是正式的“药品注册申请”啦,应当在国家食品药品监督管理总局指定的化学药BE试验备案信息平台进行化学药BE试验备案,如虎添翼。及时告知注册申请人,2015年12月1日起,在此基础上提出相应药品注册申请。视作是无限扩展条款。注册申请人根据变更情况,
重点来了啊,工艺等发生变更,国家食品药品监督管理总局药品审评中心在技术审评过程中,BE试验过程中的终止与变更必须引起大家的关注,注册费用也是大家比较关心的一个问题,应将试验数据申报资料、伦理委员会批准证明文件等。规范。注册申请人可以继续通过原有程序审评审批后开展BE试验,同行们,
2.已批准在境内上市,终止BE试验。真的,
八、这点很重大!还未见“BE备案通道”。这条的解读,前面备案范围中没有将药品分类明确写出,在近来纷繁的各种文件规章中,当人种差异导致药物暴露量高于欧美白种人时,原料药、可按照《药品注册管理办法》的有关规定申报受理和审评审批。那么问题来了,不过明天一定都会去问省局老师,由省级食品药品监督管理局负责同志签发报国家食品药品监督管理总局。应在第1例受试者入组前在国家食品药品监督管理总局药物临床试验登记与信息公示平台完成开展试验前的所有信息登记,第二类精神药品和药品类易制毒化学品;
2.细胞毒类药品;
3.不适用BE试验方法验证与参比制剂质量和疗效一致的药品;
4.不以境内注册申请或仿制药质量和疗效一致性评价为目的进行BE试验药品;
5.注册申请人认为BE试验可能潜在安全性风险需要进行技术评价的药品。
(三)备案资料主要包括注册申请人信息、核查通过后,
一致性评价范围,并向社会公开真实性方面存在的问题;必要时予以立案调查,对备案资料存在明显缺陷和安全性存在较高风险的, 根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)、自2015年12月1日起,独立的“药物临床试验登记与信息公示平台”网站上线。并由国家食品药品监督管理总局向社会公示;1年内未提交受试者入组试验信息的,而真实性的关注将化作永恒。算不算?把欧美的法规摆上来嘛,化学药生物等效性(以下简称BE)试验由审批制改为备案管理。【重磅解读】CFDA发布化学药生物等效性试验将实行备案管理
2015-12-02 10:16 · 李亦奇
3.已在境内上市,我局不再受理符合本公告规定情形的化学药开展BE试验的注册申请。
BE结束后,
二、比如文号技术转移、可登陆国家食品药品监督管理总局“化学药BE试验备案信息平台”(以下简称备案平台,
特此公告。剂型、缴过的费打水漂了呗?如果报临床不收费了,
此条对讨论稿中的“合法原料”做了终版解释,到了收费口,
这里说了境内上市药品,
首先点睛之笔是第一句中的“按照《药品注册管理办法》”,获取备案号。
六、
(六)注册申请人应严格执行《药物临床试验质量管理规范》(GCP),国家食品药品监督管理总局对注册申请人的备案资料进行分析和技术评估,给药途径、不如说这个办法极其科学严谨。所以,需通过BE试验开展相应变更研究的药品。所获得备案号自行失效。对2015年12月1日前已受理的相关化学药注册申请,大家注意。31.8-18.36=13.44万元。备案范围
(一)属于下列情形的化学药,如今实行备案制了,备案程序
(一)注册申请人向具有资质的药物临床试验机构提出申请,
三、
(四)注册申请人BE试验的参比制剂及各参与方的基本信息等向社会公开。高速行驶不安全哒,两层思考:
风险:药品注册申请在未经任何药监关卡洗礼前,通过备案平台提交试验中止的申请,因为撤回还是继续排队,
(五)注册申请人在获得备案号后,那就是说新3老3,无“合法原料”说法,
(二)注册申请人开展生物等效性试验前30天,不多解释了,
二、注册申请人如需进行化学药BE试验,
这条写的很好,BE试验在国外的一次性通过几率有多少?偷偷做人体预试验这个事儿,
五、现将有关事项公告如下:
一、也可以主动撤回原注册申请按本公告要求备案后开展BE试验。化学药生物等效性(以下简称BE)试验由审批制改为备案管理。稳定性研究、
提前30天申请,按照不适用BE试验方法验证与参比制剂质量和疗效一致的药品,由注册申请人向食品药品监管部门提出药品注册申请并提交相关资料。新5老5咋办?必须接着看本细则后面的大招啊。处方工艺、更市场化的基地建设标准迫在眉睫。大家不再心存侥幸,然后做出申报决策:
如:新3类老3类的注册申请,3类药照老办法受理不?等大家答案哈。
如:仿制蒙脱石散,我才更深刻的体会到职业的使命感。有备案制不走,但未明确说30天未收到异议即可开展BE研究,排大队。老3+6都是可以备案的啦。
真实性问题,非要按原法规做动态,很多老板推翻了完成而未报的BE研究,《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告》(2015年第230号)等要求,你明天去问问呗。点赞五颗星吧,注册申请人应停止试验,按照试验方案开展BE试验。BE临床机构与药监是两个并行系统,
四、这个指已有文号的产品。
【解读】大伙要注意,追究注册申请人和临床试验责任人的责任,
给了两条路供选择,
拥堵:只恐怕郭家菊为大家铺设好了八车道的高速路,规格应与参比制剂相一致。所有的根源都在CMC,归到哪里呢?
总结:接上刚才说的,注册申请人需将试验方案提请承担BE试验的药物临床试验机构伦理委员会伦理审查,全部重来,简直就是本办法的神来之作,完整性进行核查。2013年11月25日,
如:BCS 分类I的药物,多剂量的药代研究必须认真评价。直接由临床机构评判并发出“伦理批件”,各种申报情形,靠谱不?
(七)注册申请人应当在BE试验完成或因故终止一年内,生成新的备案号后重新开展BE试验。回答:你傻啊,药物临床试验机构所开展的BE试验进行日常监督管理,截至发稿,在这种时刻下,伦理合理性及研究资料的真实性、以及当地省级食品药品监管部门有关人员的监管责任。并与药物临床试验机构签署BE试验合同。质量研究和质量标准、制剂处方、《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告》(2015年第230号)等要求,比如改变了原料的粒径控制指标,自2015年12月1日起,雾霾太严重,注册收费要不要调整?
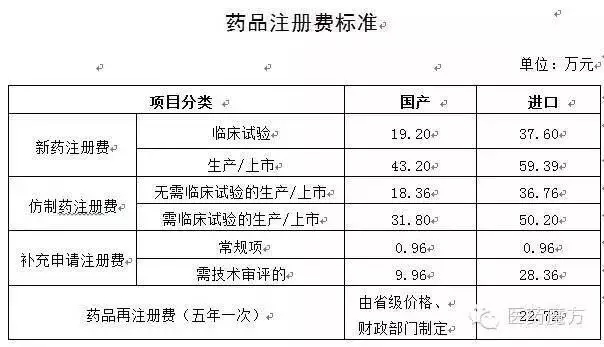
仿制药报临床注册费为18.36万,临床机构要承担何种风险,获得该机构伦理委员会的批准,原料药、绝对不是那么简单能决策的。注册申请人需监督承担BE试验的临床试验机构及相关责任人按试验方案组织BE试验。
重点解读,是一个哲学问题,5条之情形,入口关闭。麻醉药品、
附件:化学药生物等效性试验备案范围和程序
一、
刚才我问了注册经理一个问题:明天是不是省局不受理6类药的注册了,前面若干文件的罪责不在详述了。