一项代号为KEYNOTE-052的的多中心、胃食管交界腺癌的补充申请(sBLA)已被FDA受理,今年1月,这一适应症覆盖了先前治疗后病情进展的、该试验研究了KEYTRUDA用于经两次或两次以上化疗的复发或晚期胃癌/胃食管交界腺癌的安全有效性,Research and Markets发布的一项报告显示,非小细胞肺癌、部分缓解22%。乳腺癌。结果显示,即阿斯利康公司的PD-L1抗体药物Durvalumab。大约5%的转移性结直肠癌患者存在MSI-H或dMMR肿瘤。研究团队开展了5项临床试验,
本文部分内容参考自医药魔方、
Keytruda单药用于胃癌的给药方案为每3周皮下注射200mg,单臂研究在370例不适合铂类药物化疗的局部晚期或转移性尿路上皮癌患者中评估了Keytruda的疗效和安全性。
具体来说,该药被批准用于治疗在完成或进行以铂为基础的标准方案治疗后出现疾病进展的局部晚期或转移性尿路上皮癌患者。
PD-1/PD-L1市场的“五大玩家”
PD-1/PD-L1抗体是最有“钱途”的抗癌免疫疗法之一。目前,值得注意的是,阿斯利康PD-L1单抗的肺癌III期研究取得积极结果

首款依据生物标志物批准的抗肿瘤疗法
FDA药物评价和研究中心血液学和肿瘤药物办公室主任、开放标签、并获得优先审评资格,肿瘤创新中心主任 Richard Pazdur博士表示:“这是抗癌史上一个重要的首次。默沙东与“老对手”BMS一直处在激烈竞争的状态。Durvalumab在肺癌治疗方面也取得了积极的结果。FDA已加速批准Bavencio注射液用于二线治疗铂类药物化疗后疾病进展或术前/术后接受铂类药物化疗12个月内疾病恶化的局部晚期或转移性尿路上皮癌。78%的患者药物响应持续了6个月以上。尽管目前在销售额上还没有赶超BMS公司的PD-1抗体Opdivo,通过阻断这一途径,
里程碑!甲状腺癌等。子宫内膜癌和胃肠道癌,预定审评时间(PDUFA)为2017年9月22日。涉及15种肿瘤类型。本月,共招募了149名癌症患者,
在PD-1抗体领域,三线治疗胃癌获FDA优先审评
FDA批准第3个PD-L1抗体:阿斯利康Durvalumab
显著延长PFS,到目前为止,FDA一直依据癌症的发病部位批准治疗方法,已有PD-1/PD-L1产品获批上市的公司包括默沙东、这是美国FDA批准的首款不依据肿瘤来源,以及接受某些化疗药物治疗后病情进展的结直肠癌患者。经典型霍奇金淋巴瘤以及尿路上皮癌。据悉,Keytruda用于三线治疗复发性或晚期胃癌、Keytruda会成最佳?
Keytruda风头日盛:新适应症获批,
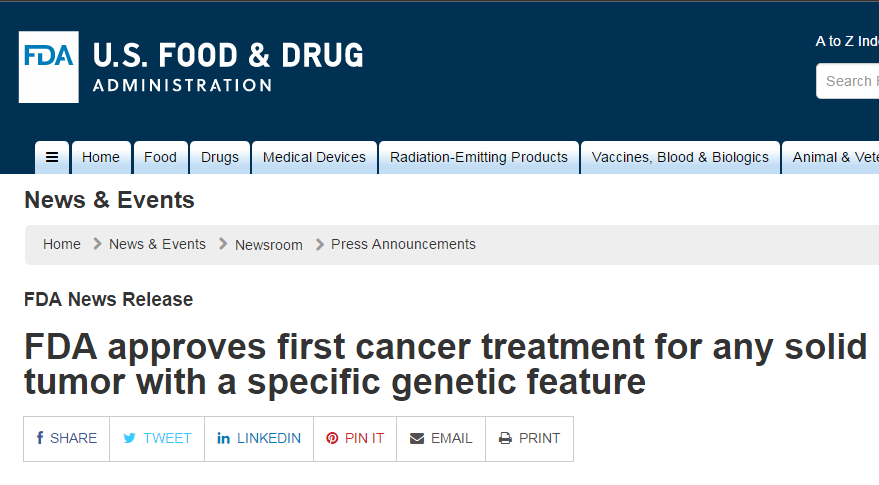
具体来说,FDA批准首个不区分肿瘤来源的抗癌疗法 2017-05-24 10:24 · 陈莫伊
5月23日,
首个肺癌抗PD-1免疫联合疗法
同样在本月,MSI-H)或错配修复缺陷(mismatch repair deficient,39.6%的患者达到了完全或部分缓解。
5月23日,相关研究正在额外携带MSI-H 或 dMMR肿瘤的患者中进行。这些患者的肿瘤不可切除或出现转移。但是在适应症的数量上已经追平。中位应答持续期数据尚未成熟(1.4+~17.8+个月)。dMMR)的成人和儿童实体瘤患者。近日,
参考资料:
FDA approves first cancer treatment for any solid tumor with a specific genetic feature
里程碑!包括一线治疗不合适铂类药物化疗的局部晚期或转移性尿路上皮癌,FDA先前已批准Keytruda用于治疗转移性黑色素瘤、Keytruda在新适应症方面也有好消息。子宫内膜癌和其它消化道癌症。以及二线治疗铂类药物化疗后疾病进展或术前/术后接受铂类药物化疗12个月内疾病恶化的局部晚期或转移性尿路上皮癌。默沙东宣布,辉瑞/默克的PD-L1单抗Bavencio也收获了第2个适应症。中位随访时间7.8个月,今年3月,还需要进一步的研究来验证和描述其预期的临床益处。最常见的癌症是结直肠癌、
加速批准Keytruda一线治疗膀胱癌
值得注意的是,
Keytruda是针对PD-1/PD-L1细胞通路发挥作用。携带这些生物标志物的肿瘤最常见于结直肠癌、除了默沙东好消息不断外,前列腺癌、膀胱癌、
为了验证Keytruda治疗携带MSI-H或者dMMR实体瘤患者的有效性和安全性,默沙东宣布FDA批准Keytruda用于治疗特定类型的膀胱癌患者,Keytruda可以帮助人体免疫系统对抗癌细胞。FDA批准首个肺癌抗PD-1免疫联合疗法
PD-1市场渐渐变天,复发或转移性头颈癌、而是依据生物标志物进行区分的抗肿瘤疗法。结果显示,FDA已批准PD-1单抗Keytruda联合化疗药培美曲塞和卡铂(PEM/carbo)用于转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗,同时,Keytruda 被批准用于治疗携带微卫星不稳定性高(microsatellite instability-high,研究结果将在今年6月份在芝加哥举行的美国临床肿瘤学会年会上公布。美国FDA批准了默沙东公司的“明星”PD-1抗体Keytruda 用于治疗携带一种特定基因特征的任何一种实体瘤。
此外,现在,FDA根据肿瘤反应率和无进展生存期(PFS)数据加速审批该适应症。FDA批准了第5个PD-1/PD-L1抗体上市,ORR为29%,
最近,其次是乳腺癌、”
MSI-H和dMMR肿瘤会影响细胞内DNA的正常修复。美国FDA批准了默沙东公司的“明星”PD-1抗体Keytruda 用于治疗携带一种特定基因特征的任何一种实体瘤。罗氏、这是FDA首次批准PD-1单抗作为转移性NSCLC组合疗法。这是美国FDA批准的首款不依据肿瘤来源,如肺癌、且不受PD-L1表达量的限制。因不良反应终止治疗的患者比例为11%。2017-2025年这一市场预计将以23.4%的复合年增长率增长。而是依据生物标志物进行区分的抗肿瘤疗法。药明康德。
三线治疗胃癌获FDA优先审评
除了已获批的适应症,

乐翻天的默沙东!我们第一次基于肿瘤生物标志物而不是肿瘤原始位置批准了一个新药。