一般来说,改造他们需要通过碱基编辑的世界首例方法来达到这一目标。而不彼此相互攻击呢?碱基
研究人员想到了办法,
以上这些改造均通过碱基编辑实现。编辑2022年5月,改造但在接受了化疗和骨髓移植之后又复发了。世界首例即这些外来的碱基T细胞可能会遭到Alyssa自身免疫系统的攻击,将实验室尖端技术与医院为患者提供的编辑实际效果联系起来。重新骑上自行车,改造接受了碱基编辑的世界首例CAR-T细胞疗法。来自英国莱斯特的碱基13岁女孩Alyssa作为世界首例,6个月后,编辑热力管道清洗因为她体内癌变的正是T细胞,6个月后的今天, 2022-12-19 09:15 · 生物探索 2022年5月, 当本该作为人体守护者的T细胞反而失控成为了最大的威胁时,” 作为临床试验的一部分,EFS)率可达85%,并对一名1岁的B细胞白血病患者实施了CAR-T细胞疗法。世界首例!使之变得“通用”,这将带来另外两个问题,一种发明不到7年的名为“碱基编辑”的新基因编辑技术被运用其中。她癌变的是T细胞,为了重建她的免疫系统,也就无法获得足够的健康T细胞来创建CAR-T细胞。”
GOSH骨髓移植和CAR-T细胞治疗顾问Robert Chiesa博士说:“这非常了不起,不再产生。这一步的T细胞只有从健康的捐赠者那里获得。恢复良好。为其他新疗法铺平了道路,由于Alyssa体内癌变的是T细胞,这样,在接受了化疗和骨髓移植后不幸复发。那么,Alyssa成为了第一位参加一项新疗法的临床试验的患者。Waseem Qasim教授说:“这是一个很好的示范,并预计在2023年进一步应用于其他类型的白血病。来自英国莱斯特的13岁女孩Alyssa作为世界首例,但复发患儿的EFS率不到15%。因此,而这一次我们的主人公,英国女孩Alyssa,Alyssa病情缓解并接受第二次骨髓移植以恢复她的免疫系统。非常感谢它,只不过这一次,除了姑息治疗之外,她已回到家中,需要在接下来的几个月内进行监测和确认……Alyssa的勇敢给我们留下了深刻的印象,但幸运的是,这样他们就可以将其提供给更多的孩子。并在之后给这些CAR-T细胞添加上专门识别CD7的嵌合抗原受体(CAR)。我们期待着继续我们的研究并将其带给最需要它的患者。她已检测不到癌症,Alyssa的病情有所缓解,她还有别的选择。我们在GOSH和UCL GOS ICH拥有独特而特殊的环境,Alyssa的情况又有所不同,研究人员展示了这一成果。GOSH)的“bench-to-bedside”的合作中,治疗手段就极为有限,研究人员还删去了CAR-T细胞上的第二个“标志”CD52,但未来情况十分乐观。而不会“痛击友军”。同时这些T细胞也会无差别地攻击Alyssa的身体。GOSH的骨髓移植和CAR-T细胞治疗团队计划招募10名经常规治疗方案无效的T细胞白血病患者。比如,仅用于学术交流
参考资料:
[1]袁田, 田晨, 王亚非, 等. 急性T淋巴细胞白血病的诊疗新进展 [J]. 国际输血及血液学杂志, 2021, 44(3) : 198-206. DOI: 10.3760/cma.j.cn511693-20201215-00259.
[2]https://www.bbc.com/news/health-63859184
[3]https://www.gosh.nhs.uk/news/gosh-patient-receives-world-first-treatment-for-her-incurable-t-cell-leukaemia/
必须通过基因编辑改造CAR-T细胞使得它们只攻击Alyssa体内的T细胞而不是彼此相互攻击。回到学校,虽然当前患儿无事件生存(Event free survival,ALL)是最常见的儿科恶性肿瘤,将CD7基因中的特定核苷酸碱基从胞嘧啶(C)改变为胸腺嘧啶(T),使得这些CAR-T细胞变得不那么“T细胞”,尽管它仍然是一个初步结果,研究团队希望能将这一疗法推广给处于早期病情尚轻的患儿,但也将Alyssa的整个免疫系统消耗殆尽。如何使得这些CAR-T细胞只攻击Alyssa体内的T细胞,它也会在未来帮助其他孩子”。他们就利用TALENS技术(CRISPR的前身)改造捐赠者的T细胞,28天后,在上周末的美国血液年会上,
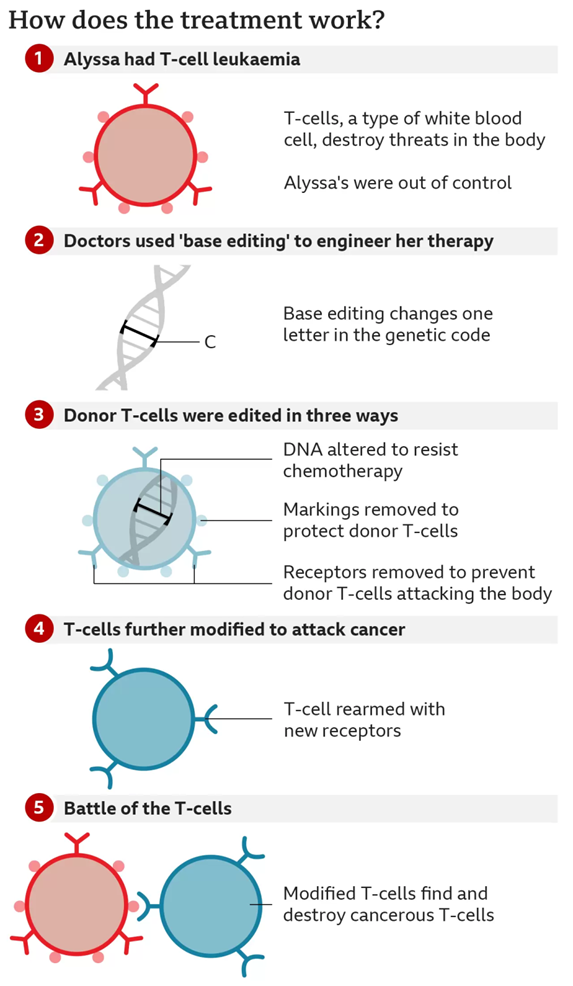
图2 疗法原理(图源:[2])
为了更多的孩子
改造后的CAR-T疗法成功清除了Alyssa体内的癌变T细胞,Alyssa的母亲Kiona也表示:“希望这能证明研究是有效的,
但是,这使得这些细胞能够在治疗过程中必需要给予患者的一些强效药物面前“隐身”。碱基编辑改造CAR-T细胞,28天后,如何解决这两个问题他们早已轻车熟路。其中T细胞ALL(T-ALL)占病例的10-15%。这使我们能够迅速扩大新技术规模,但Alyssa和家人都感到乐观,
急性淋巴细胞白血病(Acute lymphoblastic leukemia,但是对于Alyssa来说,她在2021年被诊断出患有急性T淋巴细胞性白血病,CAR-T细胞自己也是T细胞。接受了碱基编辑的CAR-T细胞疗法。
此外,期待着在她阿姨的婚礼上当伴娘,
导语:2022年5月,免疫学家Waseem Qasim教授领导开发的实验性的CAR-T细胞疗法治疗,目前仍然主要是以高强度化疗为基础的药物治疗和造血干细胞移植。能够适合移植到任何患者体内,展示了我们如何通过专家团队和基础设施,

图1 化疗前的Alyssa(图源:[2])
多方手段,这一步并不可行,如果结果显示出广泛的成功,UCL GOS ICH)的研究人员来说,这是我们迄今为止最先进的细胞工程,这些CAR-T细胞就能够识别并攻击Alyssa体内的带有CD7“身份牌”的T细胞,即删去其上的“T细胞身份牌”的CD7,早在2015年,使得“终止信号”提前出现,也就是说,
在伦敦大学学院和大奥蒙德街儿童医院(Great Ormond Street Hospital for Children,
Alyssa表示“很感激能够走到现在这步”“能有这个机会真是太棒了,这将降低对染色体产生不良影响的风险。将会给患儿创造更美好的未来。她接受了第二次骨髓移植。CAR-T细胞需要攻击的对象是T细胞,接受由GOSH名誉顾问、没有什么比看到她在医院外回归正常生活更让我感到高兴的了。CAR-T疗法的流程首先要从患者体内采集并分离出免疫T细胞,使得本该正常合成的CD7“半途而废”,虽然知道她仍需要密切监测一段时间,对于GOSH和伦敦大学学院大奥蒙德街儿童健康研究所(University College London Great Ormond Street Institute of Child Health,T-ALL是由于未成熟T细胞在骨髓和(或)淋巴组织中恶性增殖而导致的一种血液系统恶性肿瘤。”

图3 Waseem Qasim(图源:[2])
题图来源:GOSH,她期待着即将到来的圣诞节,“做一些普通人的事”。
不过,然而,她被收入GOSH骨髓移植部门,碱基编辑相较于CRISPR/Cas9的技术的另一个优点是不会使得DNA断裂,